Химики СПбГУ синтезировали нетоксичные соединения, перспективные для терапии рака груди
Открытие может стать основой для разработки нового поколения препаратов таргетной терапии онкологических заболеваний. В исследовании приняли участие ученые Санкт‑Петербургского государственного университета, Тольяттинского государственного университета, Национального медицинского исследовательского центра онкологии имени Н. Н. Блохина и Белорусского государственного университета. Результаты исследования опубликованы в Chemistry — A European Journal.
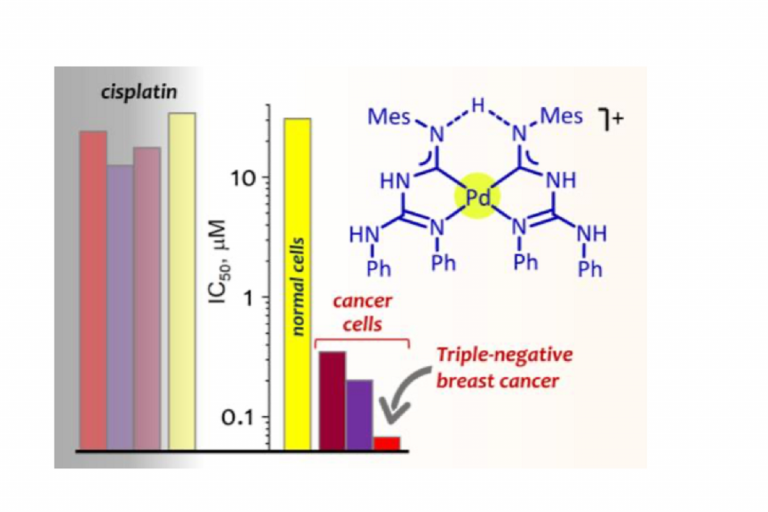 Показатель долговечности и эффективности предложенного соединения. Источник: Chemistry — A European Journal
Показатель долговечности и эффективности предложенного соединения. Источник: Chemistry — A European Journal
Группа исследователей синтезировала соединения с высокой противоопухолевой активностью, что открывает путь к разработке нового препарата для лечения онкологических заболеваний. Благодаря своей специфичности лекарство будет атаковать только раковые клетки, минуя здоровые ткани организма, и безопасно выводиться из организма без негативных побочных эффектов.
«Основой нашей разработки является органические соединения палладия. Соединения палладия обладают низкой токсичностью, в отличие от используемых в химиотерапии соединений платины, однако долгое время такие вещества считались бесперспективными для медицинского использования из‑за их быстрого разложения в организме. Благодаря продуманному дизайну молекулы нам удалось преодолеть это ограничение — синтезированные соединения обладают высокой стабильностью, растворы остаются неизменными как минимум в течение двух лет, что для химии палладиевых соединений уникально», — рассказал доцент кафедры физической органической химии СПбГУ Михаил Кинжалов.
Исключительность использованного химиками метода заключается в сборке органической молекулы непосредственно в координационной сфере металла — это позволило получить вещества, ранее недоступные для синтеза. Метод, который изобрели ученые, легко масштабируем и позволяет получать новые молекулы в одном реакторе из трех доступных и недорогих реагентов. Метод соответствует принципам «зеленой химии», поскольку все атомы реагентов встраиваются в продукт.
«Когда мы получили и протестировали эти вещества, то обнаружили соединение (хит), которое, во-первых, работает на модели одного из самых сложных клинических случаев рака молочной железы — ТНРМЖ. Во-вторых, оказалось, что оно в три раза менее токсично для эмбриональных клеток почки человека и примерно в 350 раз менее токсично для фибробластов. То есть наш хит — не просто агент, который убивает все на своем пути. Он обладает селективностью», — рассказал директор Центра медицинской химии Тольяттинского госуниверситета (ТГУ) Александр Бунев.
Хотя новые соединения могут воздействовать на разные типы раковых клеток, наибольшую эффективность они проявляют в лечении трижды негативного рака молочной железы. Этот вид рака является очень агрессивным, устойчивым к гормональной терапии и сложно поддается лечению — онкологи ограничены в выборе лечения и могут применять только химиотерапию как единственный способ лечения пациентов с трижды негативным раком молочной железы.
Соединение-лидер эффективно уже при низких наномолярных концентрациях и обладает по крайней мере в 300 раз большей активностью, чем цисплатин, в исследованиях in vitro. При этом оно сохраняет высокую противоопухолевую активность даже в условиях гипоксии благодаря способности преодолевать механизмы множественной лекарственной устойчивости, возникающие в опухолях трижды отрицательного рака молочной железы и уменьшающие эффективность существующих препаратов. С другой стороны, стоит отметить, что соединения проявили низкую активность по отношению к нормальным клеткам, что свидетельствует об их высокой селективности в отношении раковых клеток. Индексы селективности до 335 значительно превышают индексы селективности цисплатина (2−5). Ранее сообщалось о нескольких препаратах, обладающих высокой селективностью к опухолевым клеткам, но ни один из них не достигал значения индекса селективности более 100 в исследованиях in vitro.
Соединение-лидер оказалось менее токсичным для организма мышей, чем цисплатин, и превзошло его в эффективности при лечении рака молочной железы. Результаты исследования на мышах с имплантированными человеческими опухолями показали, что применение нового препарата замедлило рост опухолей по сравнению с контрольной группой. В течение 35 дней терапии было замечено снижение роста на 75% по сравнению с мышами, не получавшими лечение.
Наука
Машины и Механизмы



 Бег на месте
Бег на месте ЗА ВРЕДНОСТЬ
ЗА ВРЕДНОСТЬ









