От вкусных арбузов к суперлюдям


Искусственно вызывать мутации в генах люди научились еще в XX веке: сначала воздействуя на семена радиацией или химическими веществами. Благодаря такому внесению мутаций, которое называют ненаправленным мутагенезом, человечеству сегодня хватает еды. Прежние сорта не прокормили бы стремительно растущее население планеты. Сравните, например, дикий вид томатов Solanum pimpinellifolium с теми, которые вы привыкли видеть в супермаркетах.
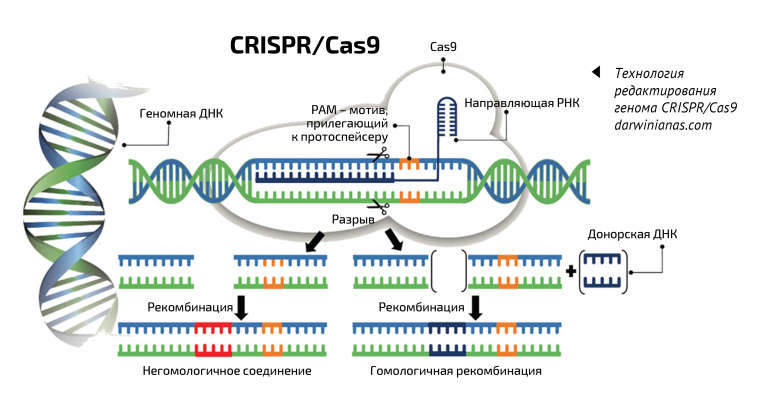
Но ненаправленный мутагенез – очень грубый метод. Используя его, в геном случайным образом вносят мутации в надежде, что получится полезный признак. Это похоже на слепое бросание тысяч баскетбольных мячей – глядишь, хоть один попадет в кольцо. Сегодня ученые знают про гены намного больше, и если можно улучшить характеристики растения точечно, хотелось бы повлиять только на них, а не палить из пушки по всей ДНК. Это возможно с современными технологиями редактирования генома – они, как хирургический скальпель, делают точный разрез там, где это необходимо.
 Дикие томаты Solanium pimpinelilfolium, exotic-seeds.store
Дикие томаты Solanium pimpinelilfolium, exotic-seeds.store
Не только растения
Редактирование генома бактерий и грибов позволяет создавать рекомбинантные биотехнологические продукты. Например, жизненно необходимый больным диабетом инсулин сегодня производит кишечная палочка, дрожжи или даже трансгенные растения (подробнее о биопрепаратах можно узнать здесь. – Ред.). А изменение генома вирусов незаменимо в создании вакцин: например, аденовирусные вакцины против COVID-19 – первые в своем роде, использующиеся в реальной практике. В них вместо поврежденных вирусов содержится часть генома коронавируса. Биотехнологическое изменение генома использовалось и раньше, для создания рекомбинантных вакцин, например, против вируса гепатита B (о методах разработки вакцин можно узнать здесь. – Ред.).
Геном человека содержит почти 30 тыс. генов, и мы до сих пор не знаем функции большей их части! Один из самых простых способов сделать это – «сломать» ген и посмотреть, что изменится. С помощью технологий редактирования генома можно внести мутации в конкретный ген, посмотреть, как это отразится на клетках или на животном, и постараться понять функцию этого гена.
Строить, а не ломать
Но еще полезнее – не ломать, а чинить гены. Известно около 6 тыс. наследственных заболеваний человека. Многие из них моногенны – то есть к ним приводят мутации всего одного гена. Это, например, фенилкетонурия и муковисцидоз. Людям с ними приходится с рождения придерживаться определенной диеты и образа жизни. При фенилкетонурии рекомендуют исключить мясные, рыбные и молочные продукты, а людям с муковисцидозом нужны постоянные ингаляции бронхолитиков (лекарства, снимающие бронхоспазм), прием антибиотиков и других лекарств. Вылечить болезнь невозможно, поскольку ее причина сидит глубоко, в гене. Сейчас, в теории, у человечества появился шанс побороть эти заболевания – при помощи редактирования генома. Исправив мутацию, можно подарить новорожденному здоровую жизнь. Но на практике мы еще к этому не готовы.
Подводные камни
Лечение моногенных заболеваний, устраняющее их изначальную причину, станет революцией в медицине. Однако необходимо тщательно исследовать технологии редактирования генома, чтобы убедиться в их эффективности и безопасности. Эффективность предполагает редактирование нужного гена, а безопасность – что нежелательные мутации не произойдут в других местах. Самой распространенной технологии редактирования генома CRISPR/Cas для клинического применения не хватает и того, и другого (о ней «ММ» писал в номере за сентябрь 2017 года. – Ред.). В 2018 году это продемонстрировал скандально известный эксперимент китайского ученого Хэ Цзянькуя, который объявил о рождении первых в мире генетически модифицированных людей. Близняшки известны под вымышленными именами Лулу и Нана. У их отца был ВИЧ-положительный статус, и ученый хотел защитить детей от риска заражения ВИЧ. Для этого он внес в их геном мутацию CCR5-Δ32, которая мешает вирусу иммунодефицита попасть внутрь человеческих лимфоцитов. Близняшки, по утверждению Хэ, родились здоровыми. Однако ни у одной из них редактирование не прошло по плану. У Лулу ген изменился лишь в одной из двух хромосом (и то не полностью), а у Наны хромосомы изменились по-разному. Пока неизвестно, будут ли девочки защищены от ВИЧ, а также повлияло ли редактирование генома на их здоровье: настоящие имена и местоположение детей скрывают. Зато точно понятно, что применять CRISPR/CAS к эмбрионам для ЭКО еще рано. Научное сообщество осудило эксперимент Хэ Цзянькуя, а сам ученый получил три года тюрьмы и огромный штраф. Он нарушил не только китайское законодательство, но и международные нормы: в 2015 году Китай, США и Великобритания договорились об ограничениях в области геномного редактирования человека. А в Китае еще с 2003 года запрещено выращивать модифицированные бластоцисты (первая стадия развития эмбриона после оплодотворенной яйцеклетки) дольше 14 дней, а также перемещать их из пробирки в тело животного или человека.
Редактирование генома можно применять и к взрослым людям. Такие изменения не передадутся потомкам, потому что будет затронут геном тела человека, а не его половые клетки. Например, редактирование генома исследовалось для терапии серповидно-клеточной анемии (США, 2018), амавроза Лебера, вызывающего слепоту (США, 2019), и некоторых видов рака (Китай, 2014). Результаты исследований на мышах, опубликованные в 2019 году группой ученых из Южной Кореи, уже показали безопасность генного вмешательства при заболеваниях сетчатки. После редактирования генома в сетчатке у грызунов на протяжении всей жизни не было ни функциональных, ни морфологических нарушений. А ученые из США в 2020 году доказали, что редактирование генома иммунных клеток открывает новые перспективы для иммунотерапии опухолей. Помимо полезных медицинских применений есть и косметические. Например, при помощи редактирования генома можно будет навсегда поменять цвет и форму волос. Когда-нибудь.
Бояться ли появления суперсолдат?
Люди опасаются неконтролируемого использования технологий редактирования генома. Вдруг какая-нибудь страна вырастит армию сверхсильных людей с высоким интеллектом? Но невозможно повесить один магнит на холодильник и надеяться, что в доме станет уютно. Точно так же и с интеллектом. Ученые до сих пор не знают функции большего количества генов, но даже если бы и знали, интеллект – это не следствие работы какого-то одного гена, а результат их сложного взаимодействия и влияния среды, в которой растет человек. К тому же все генетические процедуры будут строго регулироваться законами.
Более реальный риск технологий редактирования генома – социальное неравенство, если новые методы будут доступны не всем. Впрочем, это не аргумент против их внедрения. Наоборот, быстрое развитие метода поспособствует его удешевлению и распространению. Когда создавался проект «Геном человека», на прочтение генома выделили $3 млрд – по доллару на каждый нуклеотид. Сегодня любой желающий может узнать последовательность своей ДНК примерно за $500-1000 (услугу легко найти в онлайн-поисковике по запросу «секвенировать свой геном»). За каких-то два десятилетия цена снизилась в три миллиона раз! Чем быстрее идет развитие технологии, тем доступнее она становится для обычных людей.
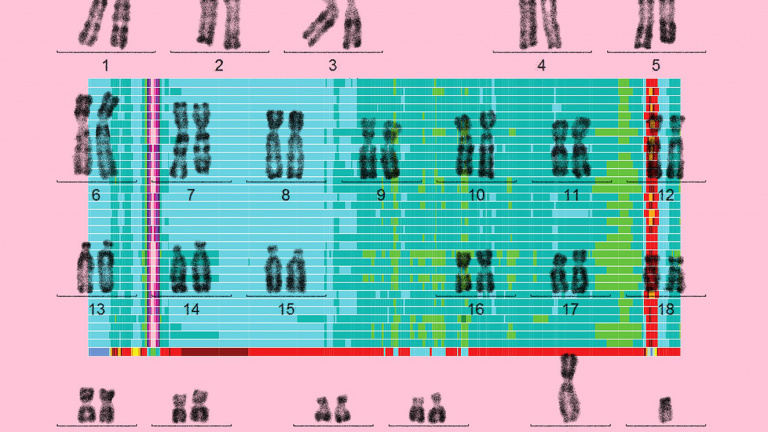 В 2003 году завершился проект «Геном человека», целью которого была расшифровка ДНК человека, хотя у некоторых участников последовательность оставалась нечеткой. В 2021 году ученые анонсировали первую полную расшифровку всего генома человека – всех 3,055 млрд букв на 23 хромосомах. Фото: Olympia Valla / Getty; Nurk et al. Katie Martin / The Atlantic, theatlantic.com
В 2003 году завершился проект «Геном человека», целью которого была расшифровка ДНК человека, хотя у некоторых участников последовательность оставалась нечеткой. В 2021 году ученые анонсировали первую полную расшифровку всего генома человека – всех 3,055 млрд букв на 23 хромосомах. Фото: Olympia Valla / Getty; Nurk et al. Katie Martin / The Atlantic, theatlantic.com
На вопросы «ММ» ответил Игорь Леонидович Радченко, ведущий научный сотрудник Научно-исследовательского комплекса «Иммунобиотехнология и генная терапия» института биомедицинских систем и биотехнологий Санкт-Петербургского политехнического университета Петра Великого (СПбПУ).
– Какие возможности для людей открывает редактирование генома?
– В ближайшем будущем – терапия моногенных и других заболеваний. В далеком будущем, по моему мнению, будут возможны самые фантастические прогнозы, как, например, люди-амфибии, которые смогут плавать без аквалангов под водой. Но есть конкурирующая технология – можно получать те же впечатления без модифицирования. В таком случае будет развиваться кибернетический сценарий, начиная от виртуальной реальности: человек наденет очки или костюм и получит те же впечатления. И тот, и тот сценарий технически возможны. Пока нельзя сказать, по какому пойдет человечество.
– Какие проблемы необходимо решить, чтобы внедрить редактирование генома в медицину?
– Генетика – только относительно точная наука, и в ней есть большое количество допущений. Во-первых, как бы мы ни хотели, мы не можем со стопроцентной уверенностью гарантировать изменения, которые захотим внести. Во-вторых, изменения только относительно прогнозируемы: неизвестно, к чему точно приведет вмешательство. И, в-третьих, генетика – наука вероятностная. С определенной вероятностью мы вносим изменения в определенный набор генов. Но мы никогда не можем гарантировать, что точно произойдет и какой будет результат. Мы можем только сказать, в каком проценте клеток вероятно произойдет результат и к каким последствиям это может привести. Все эти процессы вероятностные, и вероятности работают для каждого гена: где-то поменяется один ген, где-то другой, где-то гены останутся неизменными. В связи с этим очень тяжело прогнозировать результаты, и нет идеальных методов внесения генетических изменений. Сейчас генетические изменения стараются проводить только в ситуации, когда иначе нельзя: угроза смерти, сложностей, непереносимых заболеваний. Например, онкобольные на серьезной стадии заболевания: либо экспериментальное лечение, либо фатальный исход. Только в этом случае ученые могут позволить себе играть с генетикой.
– Эти проблемы решатся в будущем, или они всегда будут преследовать генетику?
– Я уверен, что в ситуации, когда будет выбор – «либо смертельная болезнь, либо терапия», появление еще одного метода лечения полностью оправдано. Тогда, безусловно, нужно предоставить человеку возможность терапии. В ситуации же, когда человек стоит на берегу моря и говорит: «Вот бы мне жабры, чтобы полчасика поплавать, – товарищ ученый, сделай мне инъекцию», – то вопрос открыт. И он этический, а не технологический. Но развиваются и компьютеры, и цинизм, в том числе и у ученых. Поэтому я не сомневаюсь, что есть полузакрытые или полностью закрытые лаборатории, в которых идут эксперименты на человеческих эмбрионах. Во многих странах на такие процедуры наложено табу. Но это не значит, что нет других стран, в которых этим можно заниматься.Наука
Владимир Шитов





 Когда сезонная миграция сильно ограничена: кондиционеры и как с ними жить
Когда сезонная миграция сильно ограничена: кондиционеры и как с ними жить Хвосты, бабушки и небо в алмазах: необычные факты о древних людях
Хвосты, бабушки и небо в алмазах: необычные факты о древних людях Зоопарк виртуальных чудищ: на что способны VR-технологии
Зоопарк виртуальных чудищ: на что способны VR-технологии Энергия по воздуху: все способы зарядить дрон
Энергия по воздуху: все способы зарядить дрон








