Укол на опережение


– Андрей Владимирович, над чем сейчас работаете вы и ваши коллеги?
– Мы занимаемся направлением РНК-вакцин. Наша цель – создание вакцинной платформы на основе самореплицирующихся РНК (срРНК). Это один из вариантов мРНК-вакцин. Однако, в отличие от обычных мРНК, срРНК способны некоторое время реплицироваться (размножаться) внутри клетки, что позволяет снизить на порядок концентрацию исходных молекул в вакцинной дозе.
– Что значит РНК-вакцины? И какие они еще бывают?
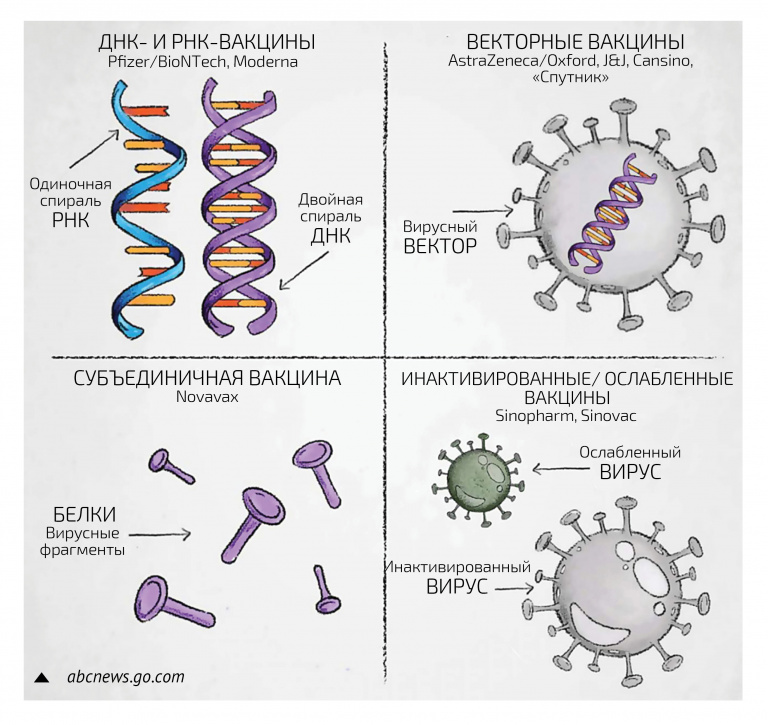
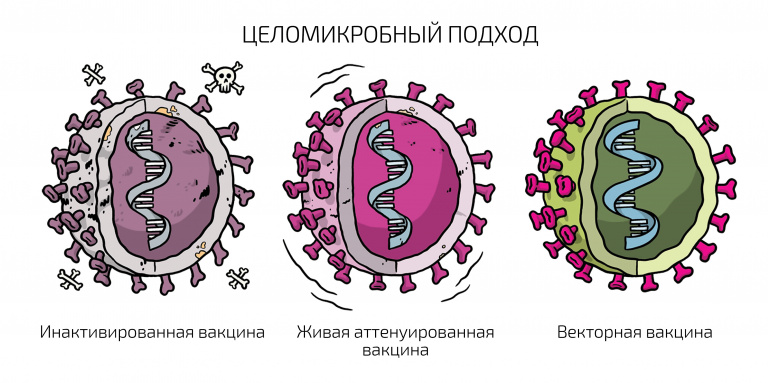
– Вакцины делятся на пять типов. Первый – традиционные живые. Они известны всем и основаны на ослабленных вариантах патогена, которые получают в лаборатории. Этот вид вирусов или бактерий способен размножаться, но не вызывает заболевания. Яркий пример – живая вакцина от полиомиелита. Точно так же устроена живая вакцина от гриппа.
Второй тип – инактивированные вакцины, когда на производстве получают большое количество вируса и каким-то химическим методом нарушают его жизнеспособность. Но при этом все белки его сохраняются и организм дает иммунный ответ. Это тоже традиционный подход, который показывает неплохие результаты с точки зрения иммуногенности и протективности (защиты).
Третий тип – рекомбинантные вакцины. В этом случае сам вирус не нужен, лишь его синтетические белки, например S-белок, который получают при помощи специальных биореакторов. Этот тип не требует наличия самого вируса, но у него есть недостаток – не очень высокая иммуногенность. Поэтому для них необходимо использовать адъюванты – специфические молекулы, которые стимулируют иммунный ответ.
Четвертый тип вакцин – те самые, о которых сегодня много говорят: знаменитый «Спутник», вакцины от Johnson & Johnson и AstraZeneca, китайская CanSino. В этом случае для доставки гена, который кодирует вакцинный белок (в данном случае это S-белок – шип, выступающий над поверхностью коронавируса), применяется другой вирус. Различными генетическими модификациями этот вирус ослабляется, то есть он, как правило, не может размножаться в организме. Но он попадает в клетки, и после этого начинается экспрессия генов – процесс, в ходе которого наследственная информация от гена преобразуется в мРНК и далее в белок. В том числе, экспрессируется и S-белок, который вызывает иммунный ответ против COVID-19.
И, наконец, последний тип – ДНК- и РНК-вакцины. Про первые мы говорить не будем, потому что зарегистрированных ДНК-вакцин еще нет, и не факт, что они вообще появятся. А что касается РНК-вакцин, то их принцип таков. Методом in vitro транскрипции в бесклеточной системе синтезируется молекула мРНК, кодирующая белок (или белки) вируса, упаковывается в какой-то носитель, например липосому, чтобы мРНК могла попасть внутрь клетки. После этого внутри клетки мРНК транслируется, и образуются вакцинные белки, которые вызывают иммунный ответ организма. То есть по сути технология достаточно простая, ведь нам не нужен ни сам вирус, ни вирус-носитель (вектор). Другое дело, что эта технология относительно новая (хотя и была предложена почти 30 лет назад), поэтому пока не совсем отработана.
– Как разрабатывают вакцины?
– В несколько этапов. Первый – исследовательский этап, когда ученые выбирают платформу, на основе которой будет разрабатываться вакцина. Этот этап может длиться долго – от года до трех и более, в зависимости от условий и задач. Тогда же проводятся эксперименты на лабораторных животных, чтобы понять, насколько эта вакцина иммуногенна (вызывает ли она иммунный ответ) и насколько она может давать защиту. Как правило, для исходных экспериментов используют мышей, однако не каждый вирус, заражающий человека, способен вызвать заболевание у мышей. Поэтому могут использоваться и другие животные, восприимчивые к изучаемой инфекции. Кроме того, как правило, сначала разработку проверяют на мелких животных, а потом на крупных, по возможности на приматах.
После того как прототип вакцины готов, начинаются доклинические исследования. В среднем они длятся от двух до четырех лет. На этой стадии на животных моделях проверяются два основных показателя будущей вакцины: безопасность (чтобы не было побочных эффектов) и иммуногенность, но уже не в рамках научных исследований, а в строгом соответствии с требованиями, прописанными в регламентирующих документах.
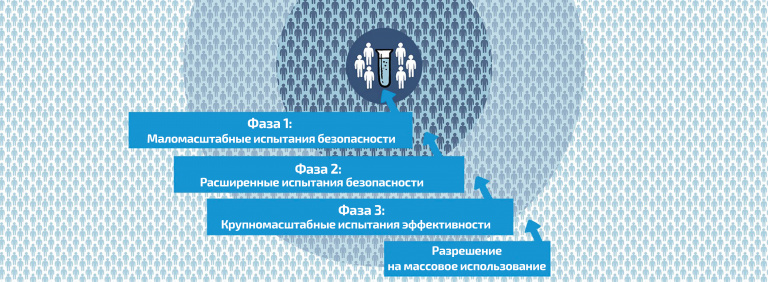
Когда эти два этапа пройдены – начинаются уже клинические исследования, то есть проверка эффективности и безопасности вакцины на людях. Клинические испытания проходят в три фазы. В первой фазе оценивают безопасность, в ней участвуют волонтеры, число которых по понятным причинам невелико – от десятков до пары сотен человек. Если этап прошел успешно – начинается второй: изучение иммуногенности, насколько вакцина активирует иммунный ответ. В этом случае исследования проводятся на сотнях и тысячах добровольцев. При успешном результате начинается третья фаза на тысячах и десятках тысяч человек. Здесь проводится оценка того, насколько вакцина в целом защищает от заболевания. Если речь идет о респираторных вирусных инфекциях, то клинические исследования занимают от 2–3 лет. После того как все эти этапы успешно пройдены – подаются документы на получение регистрационного удостоверения. И даже после торжественного «перерезания ленты» начинается пострегистрационная фаза, когда продолжают собирать данные о безопасности и эффективности. Понятно, что этот этап может продолжаться до бесконечности.
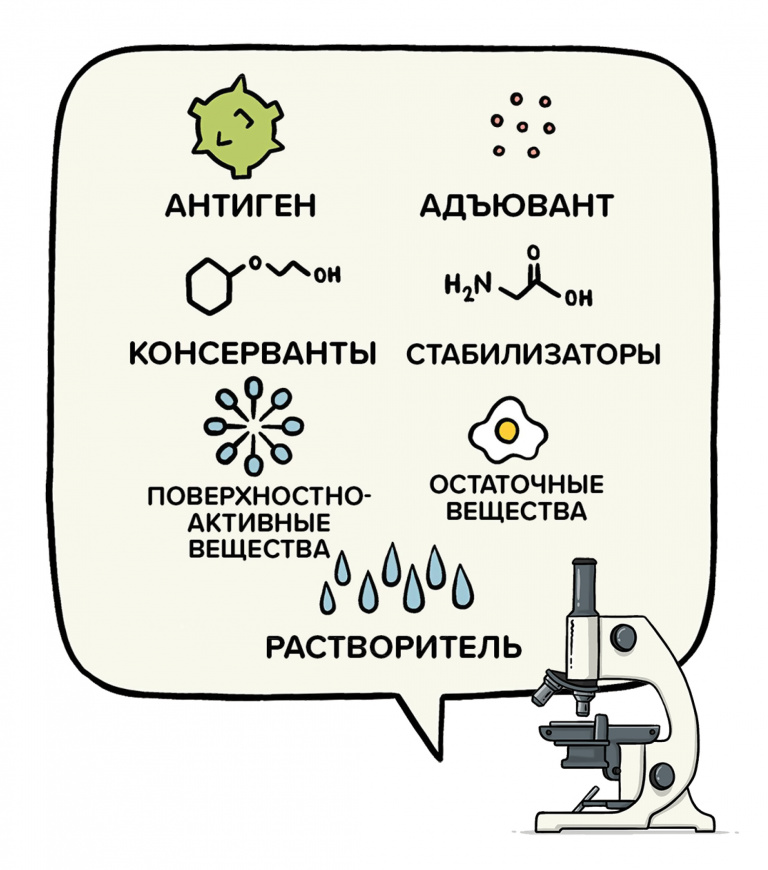 Какие ингредиенты входят в состав вакцины. who.int
Какие ингредиенты входят в состав вакцины. who.int
– Как в таких экстренных условиях, которые сложились сегодня, проверяется безопасность и эффективность вакцины?
– В нашей стране, как и в других государствах, есть федеральные законы, которые регулируют обращение лекарственных средств. Существует и ускоренный порядок разработки вакцин и других лекарственных средств и изделий медицинского назначения в чрезвычайных обстоятельствах. В этом случае все вышеописанные этапы тоже проходят в обязательном порядке, но по упрощенной и ускоренной схеме. Практически отсутствует, к примеру, стадия разработки. В экстренных условиях используют наработки и технологии, которые уже существуют для других аналогичных вакцин. Так, в Национальном исследовательском центре имени Н. Ф. Гамалеи уже велись разработки вакцин от других коронавирусов. Поэтому им достаточно было заменить нужный белок, чтобы в кратчайшие сроки начать остальные этапы.
Если в нормальном режиме все делают поэтапно, то в таких условиях, как сейчас, некоторые процессы проводят параллельно друг другу. Проблема заключается в том, что если изначально ты ошибся с дизайном вакцины, то шансов исправить что-то, по сути, нет – ты просто сходишь с дистанции. Именно такая история произошла, например, с одной из австралийских вакцин от COVID-19. На стадии клинических исследований оказалось, что люди, вакцинированные этим препаратом, давали ложноположительный результат при тесте на ВИЧ из-за того, что в его составе был фрагмент белка вируса иммунодефицита человека. Поэтому в таких экстренных условиях, как сейчас, выдается временное регистрационное удостоверение уже после прохождения второй фазы, когда удалось показать безопасность и иммуногенность вакцины.
– Как вы считаете, подобные наработки и такое большое внимание к этой теме помогут нам в будущем бороться не только с коронавирусной инфекцией, но и с другими типами вирусов?
– В 1980-е годы к вирусам стали относиться немного равнодушно (может быть, за исключением обнаруженного вируса иммунодефицита), вакцины против многих инфекций существовали, считалось, что в случае необходимости их можно сделать, и этого достаточно. Но когда появились вирусы «птичьего» и «свиного» гриппа и другие мало известные обывателям инфекции (например, лихорадки Эбола и Зика), стали задумываться о том, что пандемии будут случаться, а мы не совсем готовы с ними бороться. Большую пандемию вирусологи ждали давно, и вот она пришла. Тем не менее, готовность в мире была недостаточной, поэтому тот задел в области вакцинологии, который сейчас получен, безусловно, продвинет эту отрасль вперед.
– В чем особенности антиковидной вакцины?
– Основная часть антиковидных вакцин (кроме инактивированных) сделана только на основе спайк-белка SARS-CoV-2. С одной стороны, он дает неплохой иммунный ответ, с другой – из-за того, что он очень вариабельный, эффективность основанных на нем вакцин для новых вариантов вируса может снижаться. В этом смысле все антиковидные вакцины – это вакцины первого поколения, которые будут модифицироваться в ближайшие годы.
Наука
Ольга Фадеева




 Кто подставил нейронные сети
Кто подставил нейронные сети  Автожир: «опоссум» летательного мира
Автожир: «опоссум» летательного мира От винта!
От винта! Врата богов и город грехов
Врата богов и город грехов Паприка раздора
Паприка раздора








