Мелкий уровень

1. Вирусы
Антибиотики были величайшим открытием в медицине прошлого века, и некоторое время казались панацеей. Однако быстро выяснилось, что случайно выжившие после лечения возбудители инфекций могут мутировать. Многие из бактерий, в середине XX века погибавшие от простого пенициллина, обзавелись большим набором генов, придающих им устойчивость к десяткам антибиотиков. Так произошло с возбудителем туберкулеза. Чтобы не допустить развития «супербактерий», от которых не будет спасения, ученые озаботились поисками альтернативы антибиотикам. Ими могут стать бактериофаги, что с греческого означает «пожиратели бактерий».
Бактериофаги, или просто фаги, - это вирусы, живущие в бактериях. Они были открыты в России еще в начале прошлого века, однако поставить на поток производство лекарств на их основе не удалось из-за неразвитости биологии. С тех пор наука шагнула вперед, ученые научились культивировать фаги и превращать их в лекарственные формы, но это решило лишь часть проблем. Теперь исследователи бьются над задачей, как доставить лекарства к нужному органу. Если очаг инфекции располагается на коже или слизистой, до него легко можно «дотянуться» аэрозолем, клизмой или капсулой, растворяющейся в кишечнике. До бактерий, поселившихся во внутренних органах, добраться уже сложнее, так как иммунная система организма обычно начинает атаковать чужеродные белки бактериофагов. К тому же, некоторые бактерии живут внутри клеток (к примеру, те же туберкулезные палочки), и через этот барьер фагам не пробраться.
Тем не менее, определенных успехов уже удалось достичь. Например, в прошлом году были опубликованы результаты исследований американских ученых. Они научили бактериофаги заражать только те бактерии, которые приобрели устойчивость к определенным антибиотикам.
У таких бактерий на поверхности появляются измененные белки, на которые и реагируют созданные исследователями бактериофаги. Как только цель найдена, фаги впрыскивают в бактерию часть своей ДНК и тем самым убивают ее.
2. Бактерии
Далеко не все бактерии, поселяющиеся в человеческом организме, приносят ему вред, есть и те, что могут работать на благо. И речь идет не только о живых культурах бифидо- или лактобактерий, которые восстанавливают нормальную микрофлору слизистых оболочек. Некоторые типичные для человека бактерии можно научить распознавать и уничтожать болезнетворные микроорганизмы, при этом не нанося вреда полезным. Ученые из Сингапура до - бились впечатляющих результатов: в обычную кишечную палочку они внедрили гены, которые заставляют ее вырабатывать токсичные вещества при обнаружении синегнойной палочки. Эксперименты на мышах показали, что таким способом можно избавить организм от этого крайне устойчивого к антибиотикам микроба, который вызывает тяжелые формы пневмонии.
Бактерии могут помочь не только при лечении инфекционных болезней. В 2013 году была опубликована статья американских ученых, решивших использовать их как транспортное средство для противораковых лекарств. Для проведения экспериментов выбрали один из самых опасных видов рака – аденокарциному. Эту опухоль, возникающую в поджелудочной железе, обычно удается обнаружить только на последних стадиях развития болезни, когда метастазы распространились по всему организму и чем-то помочь почти невозможно. Но, использовав палочковидную бактерию листерию для переноса радио - активных частиц рения к раковым клеткам (где бы они ни спрятались в организме), ученые зафиксировали исчезновение 90% метастаз у экспериментальных животных, при этом не было нанесено никакого вреда здоровым тканям. Хотя эти опыты проводились всего лишь на мышах, ученые надеются вскоре перейти к клиническим испытаниям и таким образом положить конец четвертьвековому застою в борьбе с болезнью.
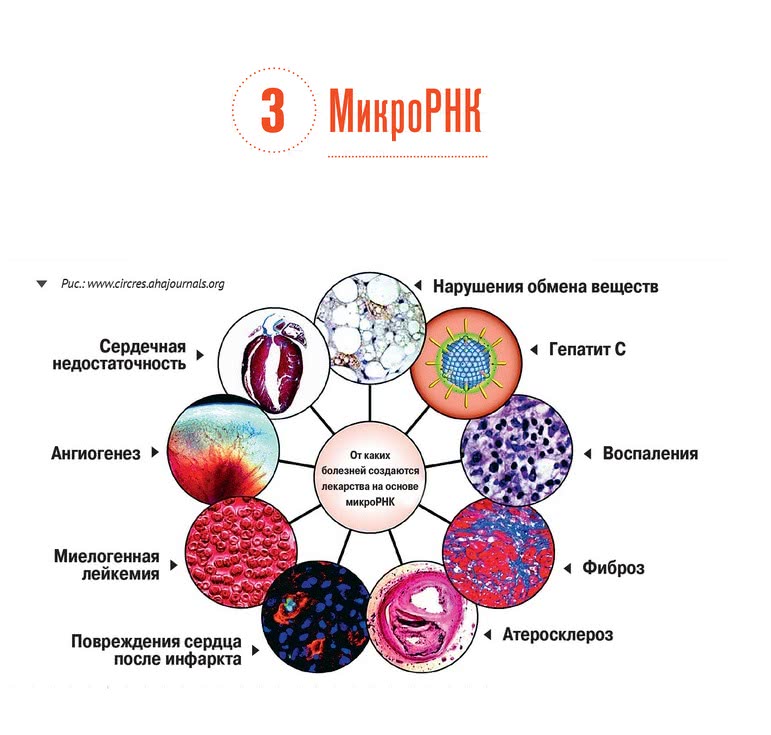
Всего 30 лет назад казалось, что рибонуклеиновые кислоты (РНК) занимаются в основном построением белков по инструкциям, записанным в генах, и не обладают никакими регуляторными функциями. Однако в начале 90-х выяснилось, что существует целый мир микро-РНК, которые сами по себе не участвуют в синтезе белков, но занимаются регуляцией этого процесса. Это навело ученых на мысль о создании лекарств на основе микро-РНК, способных выключать те гены, работа которых является причиной болезни. Эффект от применения микро-РНК можно сравнить с тем, что дает лечение генной терапией, но при этом ДНК пациента остается нетронутой и лечение при необходимости можно прервать. В 1998 году исследователи из США продемонстрировали, что можно создавать самоупаковывающиеся частицы из РНК. Их размер так мал, что они вполне попадают под определение наночастиц. Однако первые опыты показали, что наноструктуры, состоящие только из РНК, химически нестабильны и легко разрушаются белками в плазме крови. Кроме того, как и бактериофаги, они не могут преодолеть мембрану клеток. На решение первой проблемы исследователи потратили 15 лет, и теперь вплотную занялись второй.
Есть несколько тяжелых заболеваний, для лечения которых препараты на основе РНК могут стать первыми эффективными средствами. Одним из них является наследственная болезнь нервной системы – синдром Хантингтона. У страдающих ею постепенно отмирают клетки мозга из-за накопления в них мутантной формы белка хантингтина. В прошлом году исследователи из США показали, что введенные в клетки микро-РНК могут тормозить накопление опасного белка более чем в два раза, и тем самым, как минимум, замедлять развитие болезни. Конечно, от проведенных ими опытов на мышах до создания реального лекарства путь не близок. Но теперь у тысяч страдающих от этой болезни впервые появилась надежда на выздоровление.
25 лет назад стартовал международный проект по чтению генома человека. Тогда ученые всерьез надеялись, что его расшифровка поможет понять, как работает наш организм, и как можно вылечить если не все, то многие болезни. В результате 10 лет кропотливой работы генетики обнаружили, что ДНК человека содержит всего лишь 20-25 тысяч генов, а не 100 тысяч, как это предполагалось ранее. Однако механизм взаимодействия между генами так и остался почти таким же загадочным, как и во времена догеномной эры.
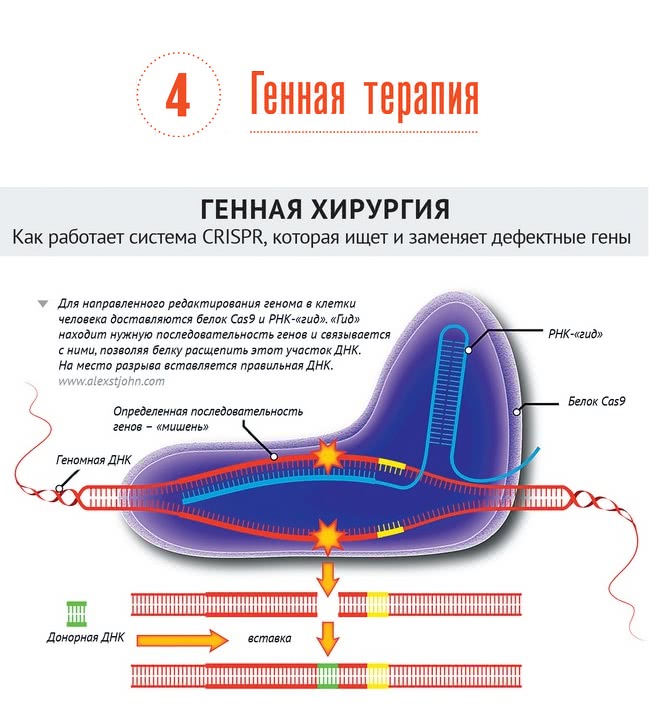
Тем не менее, декодирование генома позволило ученым узнать структуру многих белков, ответственных за развитие врожденных заболеваний и за наследование предрасположенности к болезням. Это дало толчок началу разработки принципиально новых лекарств, основанных на методах генной терапии - замене или исправлении «бракованных» генов. Список болезней, которые сейчас пытаются лечить таким образом, уже довольно длинный: редкие заболевания крови, костей, глухота, эпилепсия, дегенерация сетчатки глаза, рак груди, и даже ожирение. При этом многие методы лечения проходят последние стадии клинических испытаний. Мощный импульс развитию генной терапии дало изобретение метода редактирования генома CRISPR два года назад. Этот метод распознает дефективные участки ДНК с помощью РНК, вырезает их и меняет на нормальные последовательности.
Чтобы доставить «правильные» гены в клетки внутри организма, исследователи используют различные способы — к примеру, прикрепляют отрицательно заряженные молекулы нуклеиновых кислот к положительно заряженным частицам липидов и полимеров, которые, защищают их от повреждений, и облегчают им вход в клетки-мишени. Более эффективная технология использует измененные вирусы, в которых заменяют большинство генов (тех, что ответственны за развитие болезни и за способность вирусов к размножению), на те, что нужны для лечения.
5. Нанотехнологии
Когда ученые разрабатывают лекарство, они должны решить две проблемы – как сделать так, чтобы оно лечило болезнь и при этом не повреждало здоровые ткани. Чтобы уменьшить количество побочных эффектов, в идеале лекарство должно попадать точно в цель – в больной орган, или даже к конкретным больным клеткам. Подобного рода «золотые пули» технически возможно создавать уже сейчас с помощью нанотехнологий.
К нанотехнологиям, по большому счету, относятся все технологии, основанные на работе частиц, размер которых не превышает 1000 нанометров. То есть, сюда входят и самоупакованные частицы РНК, и ультрамикроскопические нерастворимые в воде порошки, несущие на себе лекарство, и нанороботы.
Нанотехнологии могут служить пропуском для лекарства в труднодоступные места организма. Они могут преодолевать барьер между кровеносной системой и мозгом, или забираться внутрь определенного типа клеток. Например, для лечения детского церебрального паралича нужно погасить воспалительные процессы в центральной нервной системе, но доставить лекарство в мозг стандартными методами очень трудно. Зато это можно сделать с помощью наночастиц, покрытых противовоспалительным средством, что и было продемонстрировано в прошлом году американскими учеными в опытах на собаках. В том же 2014 году рассказали об аналогичных успехах канадские исследователи – они подтвердили, что намагниченные наночастицы могут проникать в мозг мышей. Что касается нанороботов, то разработано уже несколько их прототипов. Об одном из них, созданном в Италии, стало известно в прошлом году. Это цилиндр из нуклеиновой кислоты, диаметром всего 14 нанометров, который может доставлять лекарства к нужным белкам в пределах клетки. До применения нанолекарств в клинической практике еще далеко, ученым предстоит не только разработать их, но и проверить, как наночастицы взаимодействуют с биологическими тканями. Однако пока результаты проводимых исследований определенно внушают оптимизм.
Наука
Анна Шумицкая



 Приказ по армии искусства
Приказ по армии искусства Первый свет Вселенной
Первый свет Вселенной Увидеть все: как устроен глаз человека
Увидеть все: как устроен глаз человека На все готовенькое
На все готовенькое








