Поправьте мне геном


Как бактерия узнает чужую нуклеиновую кислоту? По ее последовательности. ДНК и РНК представляют собой длинные цепочки из четырех нуклеотидов (химических групп), и чередование этих нуклеотидов дает уникальные последовательности генов. Бактерии, чтобы узнать вирус, не обязательно «читать» весь его геном, достаточно какого-то кусочка. Так мы, открыв книгу без обложки, быстро поймем, с чем имеем дело, если увидим в каком-нибудь предложении имя Анны Карениной.
И ТУТ МЫ, НАКОНЕЦ, подошли к тому, что такое CRISPR. Это участки в бактериальной ДНК, хранящие куски вирусных геномов, своего рода картотека вирусов. Когда вирус-фаг нападает на бактерию, она не обязательно гибнет – бывает, что вирус терпит неудачу, его ДНК (для простоты говорим только о фагах, у которых геном в виде ДНК) начинает разрушаться, и тогда в распоряжении у бактерии появляются фрагменты вирусной ДНК. Бактерия эти куски не уничтожает, а встраивает в собственную хромосому. Выше мы говорили, что CRISPR – это «короткие палиндромные повторы, регулярно расположенные группами». Палиндромами называют последовательности нуклеотидов, которые одинаково читаются от конца к началу и от начала к концу, например, как слово «топот». Эти палиндромы перемежаются другими последовательностями ДНК, так называемыми спейсерными участками. И вот как раз спейсеры и есть остатки вирусов, записанные в бактериальную ДНК.

НО ДО СИХ ПОР МЫ говорили о CRISPR/Cas как о системе защиты – она портит, уничтожает чужую ДНК, проникшую в бактериальную клетку. А о биотехнологической CRISPR/Cas9 мы обычно слышим, что она исправляет неправильную ДНК. Как вышло, что уничтожитель стал редактором? Представим, что нам нужно с помощью CRISPR/Cas9 в каком-то гене исправить мутировавший фрагмент: убрать неправильную генетическую букву и поставить на ее место правильную. Никакой библиотеки CRISPR тут уже нет – мы сами синтезируем РНК, которая по своей последовательности совпадает с мутантным участком в ДНК. Эта РНК будет путеводителем для белка Cas9 – мы вручаем ее белку и отправляем их в клетку. Но кроме того, мы отправляем в клетку образец ДНК – копию той последовательности, которую собираемся отредактировать, но не в мутантном, а в правильном виде.
Cas9 находит нужный участок и режет ДНК, при этом ничего не вырезает и не вставляет. Разрывы запускают системы ремонта (репарации) ДНК, которые есть в каждой клетке. Но клетка не просто сшивает разрыв – она заменяет целый кусок ДНК, в который входят и место разрыва, и еще несколько десятков генетических букв по обе стороны от него. Вместо поврежденного фрагмента синтезируется новый на замену. Но для синтеза необходим шаблон с нужной последовательностью, и вот тут в дело вступает тот образец ДНК, который мы ввели в клетку вместе с Cas-белком. Иными словами, система CRISPR/Cas9 нужна для того, чтобы включить клеточные механизмы ремонта генома, которые в определенном месте перепишут ДНК в соответствии с нашими указаниями. Вот так это все и работает.
СИНТЕЗИРОВАТЬ РНК И ДНК нужной последовательности сейчас очень просто, особенно если нужны небольшие цепочки – а система CRISPR/Cas9 работает как раз с короткими фрагментами нуклеиновых кислот. Внедрить их вместе с белком в клетку – тоже довольно рутинная процедура. Синтезируя те или иные РНК для Cas9, можно изменить абсолютно любую последовательность.
Кроме CRISPR/Cas9, есть и другие системы исправления генома, но у них поиск места для редактирования основан на взаимодействии белка и ДНК – то есть белковая молекула сама ищет нужную последовательность. Создавать такие белки долго и трудоемко. В случае же CRISPR/Cas9 поиск ведет не белок, а РНК, которую можно синтезировать быстро и с любой последовательностью.
СИСТЕМУ БАКТЕРИАЛЬНОГО иммунитета изучают с конца 1980-х, а «геномным редактором» она стала уже в XXI веке – в 2012 году в журнале Science вышла статья с описанием того, как бактериальную CRISPR/Cas9 приспособить для биотехнологических нужд. С тех пор не проходит недели, чтобы где-нибудь опубликовали работу, посвященную этой системе: ее модифицируют, совершенствуют, испытывают на разных клетках и пытаются исправлять с ее помощью какие-то вредные мутации. CRISPR/Cas9 испытывали на дрожжах, дрозофилах, круглых червях, табаке и рисе, на клетках мышей, свиней, собак и людей. Есть модификации, которые позволяют резать либо одну цепь ДНК, либо обе сразу, либо резать не ДНК, а РНК. Есть версии метода, в которых используется «увечный» фермент – он не режет нуклеиновую кислоту, зато связан с другим белком, который может включать или выключать активность тех или иных генов. Cas9 с помощью РНК-путеводителя приходит к нужному гену и просто садится на его ДНК, а белок-пассажир уже дальше делает свою работу.
ВКЛЮЧАЯ И ВЫКЛЮЧАЯ ГЕНЫ, внося в них разные мутации, мы лучше понимаем, как они работают в организме, как взаимодействуют между собой, и с CRISPR/Cas9 подобные исследования стали проходить намного быстрее. Если же говорить о практическом применении, то с помощью CRISPR/Cas9 предполагается, например, победить лекарственную устойчивость бактерий и лишить малярийных комаров способности переносить малярию. А что до того, как CRISPR/Cas9 использовать в медицине, – читатели легко сообразят, сколь огромные тут открываются перспективы в смысле исправления вредных мутаций, истребления раковых клеток и т. д. Эксперименты говорят, что такое вполне возможно. В 2014 году в Nature Biotechnology была опубликована статья о том, как мышей избавили от тирозинемии – болезни обмена веществ, при которой из строя выходят и почки, и печень, и нервная система: животным с помощью CRISPR/Cas9 исправили соответствующий кусок в ДНК. А весной этого года в Nature Communications вышла статья, авторы которой затормозили гибель фоторецепторов в сетчатке у мышей и предотвратили слепоту у животных, предрасположенных к пигментному ретиниту (наследственному заболеванию, заканчивающемуся слепотой). И эти два примера – лишь капля в море исследований, посвященных возможностям CRISPR/Cas9.
НО МЫШИ МЫШАМИ, а что же люди? Как только CRISPR/Cas9 появился в биотехнологии, всем стало ясно, что рано или поздно дело дойдет до человека, точнее – до человеческих эмбрионов. Конечно, и у взрослого организма генетический редактор можно доставлять в нужный орган или ткань. Но если заранее известно, что ребенок получится генетически больным, то почему бы не исправить ему гены в самом начале, еще в ходе экстракорпорального оплодотворения? Тут, однако, сразу возникают этико-юридические вопросы, связанные, скажем так, с проблемой самостоятельной субъектности эмбриона. Вопросы эти до поры до времени вяло тлели в научном сообществе, пока в 2015 году китайские исследователи из Университета Сунь Ятсена не опубликовали свою знаменитую работу, о которой мы говорили в начале. Никто не думал, что эмбрион человека отредактируют так скоро. Этико-юридические дискуссии вышли на новый уровень, а пока они шли, в Китае продолжили эксперименты – и, например, в 2016 году в Journal of Assisted Reproduction and Genetics вышла другая китайская работа, в которой говорилось, что оплодотворенную яйцеклетку человека можно снабдить мутацией, защищающей от ВИЧ. В конце концов было решено, что с определенными оговорками CRISPR/Cas9 можно применять к человеческим эмбрионам. И вот совсем недавно, в начале августа в Nature вышла статья с очередными отредактированными зародышами – на сей раз эксперименты выполняли в Орегонском университете науки и здоровья.
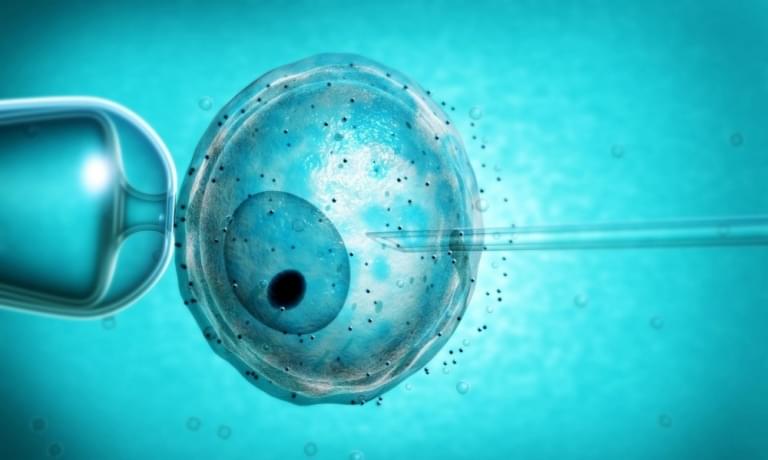 В клетку эмбриона впрыскиваются все инструменты для редактирования. www.telegraph.co.uk
В клетку эмбриона впрыскиваются все инструменты для редактирования. www.telegraph.co.uk
МЫ НЕОДНОКРАТНО УПОМИНАЛИ, что один из плюсов метода CRISPR/Cas9 – его точность. Но за это лето вышли как минимум две довольно серьезные статьи (в Nature Methods и в Nature Medicine), в которых говорится, что CRISPR/Cas9 пока что мало подходит для редактирования человеческих генов – из-за того, что очень велик риск незапланированных мутаций. Проблема в большой вариабельности наших генов: одна и та же последовательность ДНК у двух людей может отличаться на несколько букв. Хотя на функции гена такие замены часто никак не влияют, из-за них редактирующая машина Cas9 с направляющей РНК может приземлиться, кроме нужного места, еще в десятке, а то и в сотне других точек генома. Впервые о том, что разнообразие генов может ввести CRISPR/Cas9 в заблуждение, заговорили еще три года назад, но сейчас удалось количественно оценить масштаб проблемы: в некоторых случаях число ошибок может доходить до 10 000. Однако некоторые наши гены вообще не провоцируют CRISPR/Cas9 ни на какие ошибки, и с ними CRISPR/Cas9 работает исключительно точно. И объективно этот метод все-таки слишком удобен, чтобы от него можно было просто взять и отказаться, – скорее всего, биотехнологи сделают все возможное, чтобы как можно сильнее повысить его точность вне зависимости от того, какие гены ему придется исправлять.
Наука
Кирилл Стасевич


 Крошечные боги: мифы и легенды о муравьях
Крошечные боги: мифы и легенды о муравьях Цивилизация без мозгов. Как муравьи построили идеальное общество на генах, гормонах и феромонах
Цивилизация без мозгов. Как муравьи построили идеальное общество на генах, гормонах и феромонах (Нейро) химия любви
(Нейро) химия любви Органы на вырост
Органы на вырост








