Сделано из живого


Человек – часть природы, и он всегда искал в ней средства от болезней. Даже некоторые животные способны «лечить» себя, поедая растения. Такое самолечение называют зоофармакгнозией. В 1996 году биолог Майкл Хаффман (Michael Huffman) наблюдал в Танзании за шимпанзе, зараженным паразитами и страдающим запором. Примат жевал листья ядовитого растения, которого обычно избегал, а на следующий день выздоровел.
Первые лекарства, созданные человеком, тоже были натурального происхождения. Попытки лечить болезни травами, глиной и другими средствами начались, вероятно, еще в палеолите. В XX веке произошла лекарственная революция – в ее результате нас и сегодня лечит природа, но уже не только с помощью растительных экстрактов. Дело в биопрепаратах – лекарственных средствах, полученных с помощью живых организмов.
 Шимпанзе ест растение из семейства Phytolaccaceae, известное своими терапевтическими свойствами и используемое в фармацевтической промышленности. Фото: J.-M. KRIEF, lapresse.ca
Шимпанзе ест растение из семейства Phytolaccaceae, известное своими терапевтическими свойствами и используемое в фармацевтической промышленности. Фото: J.-M. KRIEF, lapresse.ca
Какие бывают лекарственные препараты?
Органические молекулы, которые используются в качестве активных веществ, можно разделить на два класса – малые и большие. Их можно рассматривать и как два поколения лекарственных средств. У малых сравнительно низкая молекулярная масса, до 900 Дальтон. Именно они лежат в основе почти всех лекарственных средств на сегодняшнем рынке. К ним относятся и вторичные метаболиты растений, бактерий и грибов, которые человек использовал в качестве лекарств. Вторичными их назвали, потому что для жизни организмов они не необходимы, так как не участвуют в росте или развитии. Таким метаболитом является антибиотик пенициллин, помогающий плесени избавиться от бактерий-конкурентов. Другие примеры – статины, сдерживающие образование новых атеросклеротических бляшек, и кортикостероиды – аналоги природных стероидов, подавляющие воспалительный процесс.
Именно с малых молекул в XIX веке началась современная фармакология: в 1897 году Феликсом Хоффманом был синтезирован аспирин, первое синтетическое лекарственное вещество. Синтез маленьких молекул прост, иногда он сводится к одной реакции. Поэтому вещества из этой группы называют химическими препаратами, противопоставляя биопрепаратам.
За более чем столетнюю историю исследования малые молекулы нашли применение и в противоопухолевой терапии, в том числе и таргетной – когда терапевтическая молекула не просто сдерживает размножение всех быстроделящихся клеток, а избирательно блокирует конкретные механизмы роста и деления раковой клетки. Благодаря этому достигается более высокая эффективность и реже возникают побочные эффекты. Так работают иматиниб, вемурафениб и другие препараты, всего их более тридцати.
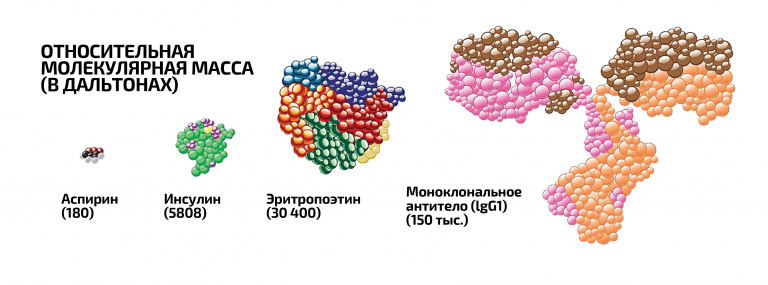 Иллюстрация: Hakan Mellstedt, researchgate.net
Иллюстрация: Hakan Mellstedt, researchgate.net
Биопрепараты или большие молекулы
Многие термины в биологии и медицине не имеют однозначной интерпретации. Это касается и биопрепаратов (больших молекул): непонятно, относить ли к ним кровь и ее компоненты, тканевые и органные трансплантаты, стволовые клетки. Мы будем придерживаться классификации, согласно которой к биопрепаратам относятся молекулы весом более 900 Дальтон, полученные методами биотехнологии с помощью живых организмов. А клеточную и генную терапию рассматривать отдельно, а не как биопрепараты, хоть они и тесно переплетаются.
Что же отличает биопрепараты (большие молекулы) от классических малых? Конечно, не только масса и размер. Прежде всего, способ производства: биопрепараты получают из живых организмов или с их помощью. Иногда они сложны настолько, что их производство состоит из сотен этапов.
Рекомбинантная ДНК – основа биопрепаратов
Большинство биопрепаратов: гормоны, антитела, интерфероны, ферменты, рекомбинантные вакцины – имеют белковую природу. Белки – это зачастую огромные молекулы, состоящие из сотен аминокислот. У них сложнейшая структура, и химический синтез большинства из них невозможен. Лучшая фабрика по производству белков – рибосома: органелла, присутствующая в любой живой клетке. В ней всю работу по производству новых белков выполняют другие белки, ферменты. Человеку же остается только создать условия для их работы и любоваться результатом. Важнейшие ферменты – аминоацил-тРНК-синтетазы, соединяющие аминокислоты в цепь. Но как заставить клетку синтезировать необходимый человеку белок? Для этого используют рекомбинантную ДНК.
ДНК – это молекула, состоящая из четырех видов мономеров, нуклеотидов. Их обозначают буквами А, Т, Г, Ц, и различные их комбинации содержат инструкцию (ген) по созданию белков любого организма. С помощью генной инженерии можно добавить новые инструкции в ДНК. Необходимый ген получают, вырезая из ДНК. Например, это может быть ген, ответственный за синтез белка инсулина. Затем нужный ген внедряют в ДНК, чаще всего используют кольцевую бактериальную ДНК. Эти этапы также проводят с помощью ферментов – рестриктаз и лигаз. Полученную рекомбинантную ДНК, то есть ДНК бактерии + нужный нам ген, внедряют в клетку бактерии-хозяина (или даже клетки млекопитающих). На этом генная инженерия заканчивается. Отбирают клетки, которые успешно прошли трансформацию, обеспечивают им необходимые условия для деления и синтеза белка, а затем физико-химическими методами выделяют полученный белок.
Гормоны
Первым рекомбинантным белком стал инсулин, полученный в 1978 году. Клеткой-хозяином послужила кишечная палочка E. Coli, а в 1982 году продукт выпустили на рынок под названием хумулин (human – человек). Препарат стал революционным: до этого инсулин получали из поджелудочных желез свиней. При этом приходилось уделять много внимания очистке инсулина от примесей, содержащихся в животном сырье. Кроме того, свиной инсулин отличается от человеческого на одну аминокислоту. С помощью химических методов ее можно заменить на «человеческую», но биотехнологическое получение эффективнее. Хотя животные инсулины применяются до сих пор, они гораздо чаще вызывают аллергические реакции – от 5 до 30 % случаев для разных препаратов. Это связано с тем, что обеспечить высокую чистоту – сложно и дорого. Иммунный ответ вызывают оставшиеся белковые примеси.
За последние 30 лет созданы различные модификации инсулина. Они производятся так же, как и обычный, но с помощью генной инженерии изменяют состав молекулы, а с ней и свойства препарата. Можно отметить гларгин, в котором заменены две аминокислоты, – у него пролонгированное действие, и он активен около суток. Другая модификация, инсулин деглудек, обеспечивает более ровную концентрацию на всем периоде действия и работает до двух суток и более. Такие препараты позволяют реже производить инъекции, не опасаясь побочных эффектов: гипер- или гипогликемии.
Еще один гормон, который нам подарила биотехнология, – это гормон роста соматотропин. До 1985 года его получали из гипофизов умерших людей, из-за чего препарата на рынке было крайне мало, и он применялся в исключительных случаях – чаще всего для лечения идиопатической низкорослости у детей. В 1985 году среди людей, которые 10–15 лет назад получали такой гормон, были обнаружены случаи болезни Крейтцфельдта-Якоба. Это заболевание вызывается прионами и часто встречается в племенах, практикующих каннибализм. После этого трупный соматотропин отозвали с рынка и больше не применяли. Уже в том же году впервые был получен рекомбинантный гормон роста и разработан соматотропин с замедленным высвобождением. Он позволял делать инъекции 2–4 раза в месяц вместо ежедневного применения. Однако его перестали выпускать из-за финансовой неэффективности, поэтому сейчас на рынке есть только классический рекомбинатный гормон роста.
Ферменты
У этих катализаторов химических реакций в живых клетках тоже белковая природа. Они участвуют во всех процессах нашего организма: копировании ДНК, пищеварении, синтезе белков. О связи между ферментами и наследственными болезнями догадались еще в начале XX века. Если в результате какой-то мутации меняется последовательность гена, то может измениться и последовательность аминокислот в белке. Это иногда приводит к снижению его активности. Один из примеров – фенилкетонурия. При этом заболевании нарушается метаболизм аминокислоты фенилаланина, накапливаются токсины, в норме не образующиеся в организме. В результате появляются тяжелейшие психические отклонения. Сегодня фенилкетонурия лечится низкобелковой диетой, но на подходе и генная терапия, и рекомбинантная фенилаланин-4-гидроксилаза. Сейчас препарат на последних стадиях клинических испытаний.
Еще один недуг, который мы лечим рекомбинантными ферментами, – муковисцидоз или кистозный фиброз – системное наследственное заболевание. При нем у человека поражены железы внешней секреции, нарушены функции органов дыхания и кишечника. Для симптоматической терапии этой болезни применяют рекомбинантную человеческую дорназа-альфу. Препарат вводят с помощью небулайзера (устройство для проведения ингаляции), и он улучшает функцию легких пациентов. Природный аналог фермента в норме содержится в крови человека и расщепляет внеклеточную ДНК. При муковисцидозе у больных в бронхах накапливается вязкий гнойный секрет с высоким содержанием ДНК. Ее расщепление дорназой-альфа уменьшает вязкость, облегчая его откашливание.
Лечение рака с помощью моноклональных антител
Антитела – еще один вид белков, продукт нашей иммунной системы. Моноклональные антитела отличаются от поликлональных тем, что их получают из одной клеточной линии. Они являются клонами друг друга, восходя к одной клетке-прародительнице, и нацелены на конкретную мишень. В организме каждое природное антитело связывается только с одним антигеном. Когда это происходит, иммунная система получает сигнал, запускающий программу уничтожения вражеского организма. В случае опухолей ее выполняют Т-киллеры, один из видов клеток иммунной системы лимфоцитов. Т-киллер можно «выключить», заблокировав рецептор PD-1 (рецепторы, кстати, тоже белки). Этот механизм нужен, чтобы избежать атаки иммунитета на свой же организм. Многие раковые клетки умеют скрываться от иммунной системы с помощью белка PD-L1, притворяясь клетками организма. PD-L1 блокирует рецептор PD-1. Именно с этим борются моноклональные антитела. Так, биопрепарат атезолизумаб связывается с PD-L1 опухоли и блокирует его взаимодействие с рецепторами PD-1 антитела. В результате Т-киллеры снова «видят» опухоль и убивают ее.
Есть и другие противоопухолевые моноклональные антитела, не только иммунотерапевтические. Например, трастузумаб – средство против агрессивной формы рака молочной железы. Повышенная экспрессия гена ERBB2 (соответствующий белок – HER2) ассоциирована с агрессивностью опухоли и неблагоприятным прогнозом. Функция HER2 состоит в регуляции роста и деления клеток. В здоровой клетке есть две копии гена этого белка, в раковой – намного больше. Это приводит к нарушению регуляции роста клеток, быстрому увеличению опухоли и устойчивости к гормональной и химиотерапии. Трастузумаб, как троянский конь, доставляет в HER-2-позитивные клетки токсин эмтанзин. Он препятствует синтезу белка тубулина, из которого построены микротрубочки, образующие цитоскелет клетки и обеспечивающие расхождение хромосом во время деления. В результате раковая клетка оказывается не способна делиться и расти. В 1998 году трастузумаб был одобрен под коммерческим названием «герцептин».
 Ученый держит стеклянную бутылку, в которой выращивают моноклональные антитела. Их можно неограниченно выращивать в лабораториях. Фото: Linda Bartlett, visualsonline.cancer.gov
Ученый держит стеклянную бутылку, в которой выращивают моноклональные антитела. Их можно неограниченно выращивать в лабораториях. Фото: Linda Bartlett, visualsonline.cancer.gov
Биопрепараты используются в терапии уже больше сорока лет. За это время они полностью изменили медицину, отменив многим смертельный приговор. Например, моноклональные антитела спасли экс-президента США Джимми Картера от четвертой стадии меланомы с метастазами в головном мозге. Рекомбинантный фермент дорназа-альфа – важнейший препарат для больных муковисцидозом без аналогов. Бич европейских монархов – гемофилия – сегодня не является проблемой: рекомбинантные факторы свертываемости позволяют больным вести нормальный образ жизни. Биопрепараты делают невозможное возможным, это настоящая магия, которая и не снилась алхимикам Средневековья. Но и магия не может быть лишена недостатков.
Один из главных – крайне высокая стоимость многих биопрепаратов. Часто их невозможно купить без поддержки государства или благотворительных фондов. В последние годы из-за того, что истекают сроки патентов на оригинальные разработки, начали выпускать более дешевые аналоги популярных биопрепаратов. Разработка аналога при этом стоит в 5–10 раз меньше, чем разработка оригинального лекарства.
Малые терапевтические молекулы, как правило, не вызывают иммунного ответа, в отличие от огромных молекул биопрепаратов. Из-за этого пациентам и врачам приходится сталкиваться с разнообразными побочными эффектами, иногда смертельными. Например, люди, проходящие терапию биопрепаратами, немного более склонны к развитию серьезных инфекций.
Крупные молекулы не проходят через гематоэнцефалический барьер, который защищает спинной и головной мозг от циркулирующих в крови токсинов, микробов и других опасных веществ и клеток. Поэтому мишени биопрепаратов в головном мозге часто все еще недоступны. Да и в целом они хуже проникают в клетки, по сравнению с малыми молекулами.
Моноклональные антитела спасли миллионы жизней, но и их потенциал не безграничен: опухоли избегают иммунных клеток другими путями. Кроме того, они не лишены побочных эффектов, как и традиционная химиотерапия.
Несмотря на все минусы, биопрепараты становятся более дешевыми, безопасными и таргетными. Недавно FDA одобрило моноклональные антитела против вируса Эболы, мигрени и еще десять биопрепаратов. В 2021 году начались продажи адуканумаба, первого за 20 лет препарата против болезни Альцгеймера. А совсем скоро нас ждет выпуск бимекизумаба против псориаза, который имеет все шансы стать лучшим лекарством от этого аутоиммунного заболевания.Наука
Анжелика Дун



 Коварство Меркурия
Коварство Меркурия Один день из жизни таблетки
Один день из жизни таблетки Аспириновая панацея
Аспириновая панацея Коловратке все нипочем
Коловратке все нипочем








