Органы на вырост

В конце прошлого года по всем СМИ пролетела новость о сирийском мальчике, которому вырастили новую кожу. У него была редкая генетическая болезнь – буллезный эпидермолиз. На самом деле так называют целую группу заболеваний, но суть у них одна: белки, которые скрепляют клетки кожи, начинают плохо выполнять свои функции, и верхний ее слой – эпидермис – просто распадается, отслаивается (буквальный перевод названия «эпидермолиз» – растворение эпидермиса). Кожа покрывается волдырями и незаживающими воспаляющимися ранами, человек страдает от постоянных инфекций, у многих начинается рак кожи. Лечения как такового нет, больных поддерживают как могут. В тяжелых случаях смерть наступает довольно быстро.
У МАЛЬЧИКА КАК РАЗ БЫЛ тяжелый случай – к моменту, когда он поступил в больницу при Рурском университете (Германия), он потерял почти 80 % эпидермиса, хотя у него все же оставались неповрежденные участки кожи. Из них-то сотрудники больницы вместе с коллегами из Университета Модены и Реджо-Эмилии (Италия) и набрали клеток-кератиноцитов (из которых состоит эпидермис) и начали выращивать их в лабораторной культуре. Попутно исправив в ДНК мутацию, ставшую причиной болезни, – испорченный ген в кератиноцитах просто заменили на нормальный. Чтобы дать больному новую кожу, понадобились три операции – в 2015 и 2016 годах, и сейчас, спустя два года, мальчик жив, здоров и никаких признаков прежней страшной болезни у него нет.
Это не первый раз, когда человеку пересаживают выращенную кожу. Но обычно, когда говорят об искусственной коже, имеют в виду специальные белковые слои, которые изготавливают в лаборатории из коллагена и других белков. Такие белковые листы накладывают на поврежденные участки, и они стимулируют деление кожных клеток, то есть помогают коже восстановиться самой. В результате на месте раны появляется настоящая кожа, а не рубец. Такой метод регенерации активно распространяется с середины 1990-х годов. Но делать кожу из собственных клеток пациента стали сравнительно недавно.МЫ ЗНАЕМ, ЧТО ВСЕ ОРГАНЫ и ткани в нашем организме получаются из стволовых клеток. И как только биологи научились работать с ними, сразу возникла идея: из этих клеток можно выращивать что угодно. Однако если мы возьмем стволовые клетки, принадлежащие кому-то другому, что-нибудь вырастим из них и пересадим себе, то немедленно получим проблемы с иммунитетом: для него чужие клетки ничем не будут отличаться от инфекции. Значит, нужно пользоваться клетками, взятыми у самого больного, – как в случае с сирийским мальчиком.
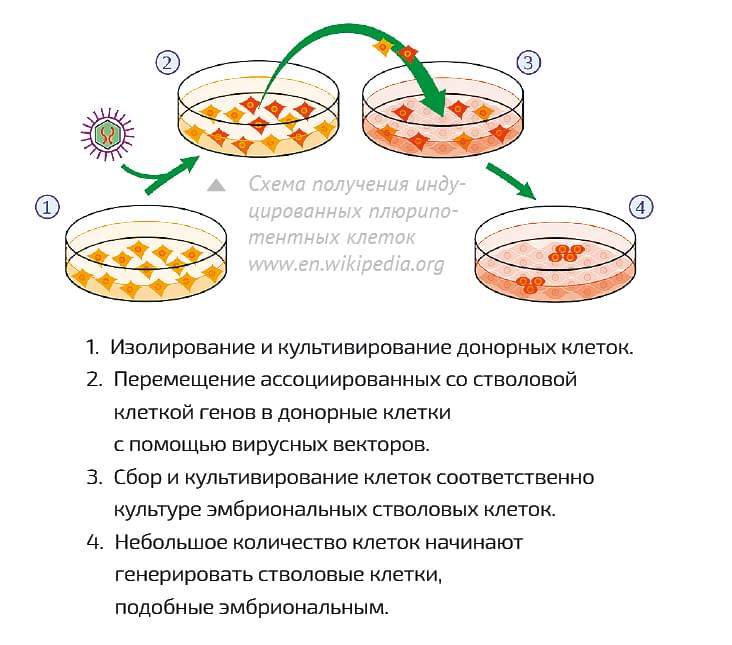
НО СТВОЛОВЫЕ КЛЕТКИ бывают разные. Они распределены по тканям и органам: например, есть стволовые клетки кожи, крови, кишечника и т. д. (таких клеток нет только у сердца). Стволовые клетки кожи могут превратиться только в зрелые, специализированные кожные клетки, но не в нейроны и не в эритроциты. Поэтому возникает проблема: что если нам нужны такие стволовые клетки, которые очень трудно извлечь? На самом деле, это уже не проблема. Сегодня мы умеем превращать дифференцированные клетки в стволовые – они называются индуцированными стволовыми клетками. (Нобелевскую премию по физиологии и медицине 2012 года дали как раз за метод, с помощью которого можно заставить зрелые клетки, так сказать, впасть в «детство».) То есть мы берем, к примеру, из кожи обычные, не стволовые клетки и обрабатываем их особым коктейлем из нескольких регуляторных белков – в итоге клетки становятся стволовыми. И по своим способностям они будут идентичны не просто стволовым клеткам, а эмбриональным, способным давать любой другой тип клеток. Из них можно получить хоть нейроны, хоть мышечные клетки, хоть кожные, главное – задать нужную программу развития. Почему же до сих пор мы не выращиваем легкие, желудки, почки, мозги, в конце концов?
ДЕЛО В ТОМ, ЧТО ВСЕ ЭТИ ОРГАНЫ – сложные трехмерные структуры. Даже кожа не так проста, как кажется, – она состоит из трех слоев (эпидермиса, дермы и нижнего жирового слоя), хотя с ней все же можно обращаться как с плоским листом. С желудком такой номер не пройдет: его нужно выращивать в 3D-формате. Кроме того, не будем забывать, что органы состоят из нескольких типов клеток: мышечных, эпителиальных, железистых и т. д.
То есть выращиваемому органу нужен какой-то костяк, трехмерная платформа, «строительные леса». Это должна быть пористая структура, к которой клетки могли бы легко прикрепляться и переползать с места на место, и чтобы их можно было легко «кормить» и снабжать разными регуляторными молекулами, направляющими развитие в нужную сторону. По мере роста клетки будут строить собственный каркас, выделяя во внешнюю среду белки и другие молекулы межклеточного вещества, которые поддерживают ткань, – значит, наш искусственный каркас должен вовремя раствориться, деградировать. И конечно, материал для «лесов» должен быть биосовместимым – то есть не вредить самим клеткам.
Чтобы орган прижился и заработал, в него должны прорасти кровеносные сосуды и нервы. К счастью, если орган простой, с этим может справиться сам организм – достаточно вовремя сделать пересадку, чтобы материал был еще в том состоянии, когда он может стимулировать в окружающих тканях рост нервов и капилляров и притягивать их к себе.
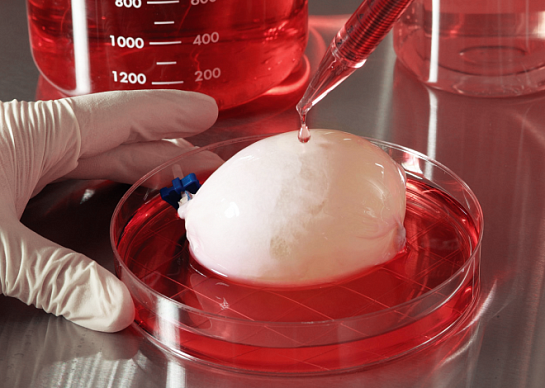
Какие органы делают таким способом? Помимо мочевого пузыря, крупные кровеносные сосуды, трахею, пищевод. Но выращенные пищеводы пока тестируют на животных, а недавний скандал с профессором регенеративной хирургии в Каролинском институте (Швеция) Паоло Маккиарини, который пересадил нескольким людям искусственные трахеи, показал, что и тут не все гладко. Доктор сильно преувеличил свои успехи – почти все пациенты с искусственными трахеями умерли вскоре после операции.
 3D-печать позволяет точно воспроизвести все изгибы. Фото: www.inhabitat.com
3D-печать позволяет точно воспроизвести все изгибы. Фото: www.inhabitat.com
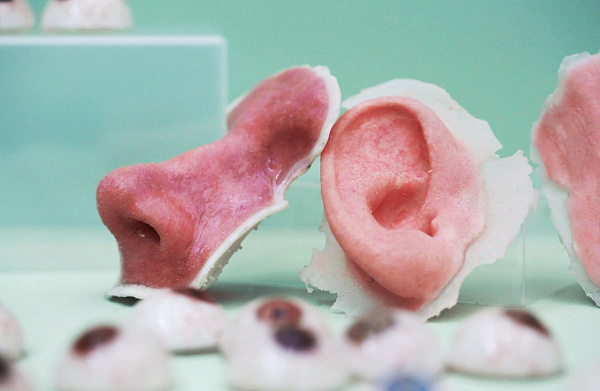
КСТАТИ, ФОРМЫ ДЛЯ УШЕЙ из биоразлагаемых полимеров печатают на 3D-принтере – трехмерная печать позволяет точно воспроизвести все изгибы, выступы и впадины. Возникает вопрос – почему бы не напечатать орган целиком? Исследования в этом направлении активно ведутся, и сейчас есть принтеры, печатающие биочернилами: смесью из белков и других биомолекул с добавлением клеток. Однако проблема в том, что клетки часто не выдерживают действие механических сдвигающих сил, проходя через сопла печатающей головки. Кроме того, чтобы напечатать полноценный орган, принтер должен манипулировать клетками сразу нескольких типов, а сделать это не всегда получается. Поэтому чаще используют бесклеточные биочернила, с помощью которых создают те самые каркасы и формы, о которых шла речь выше. Но если говорить о сложных органах, то даже каркас для них удается изготовить далеко не всегда.
 Будущее ухо. Фото: www.thirteen.org
Будущее ухо. Фото: www.thirteen.org
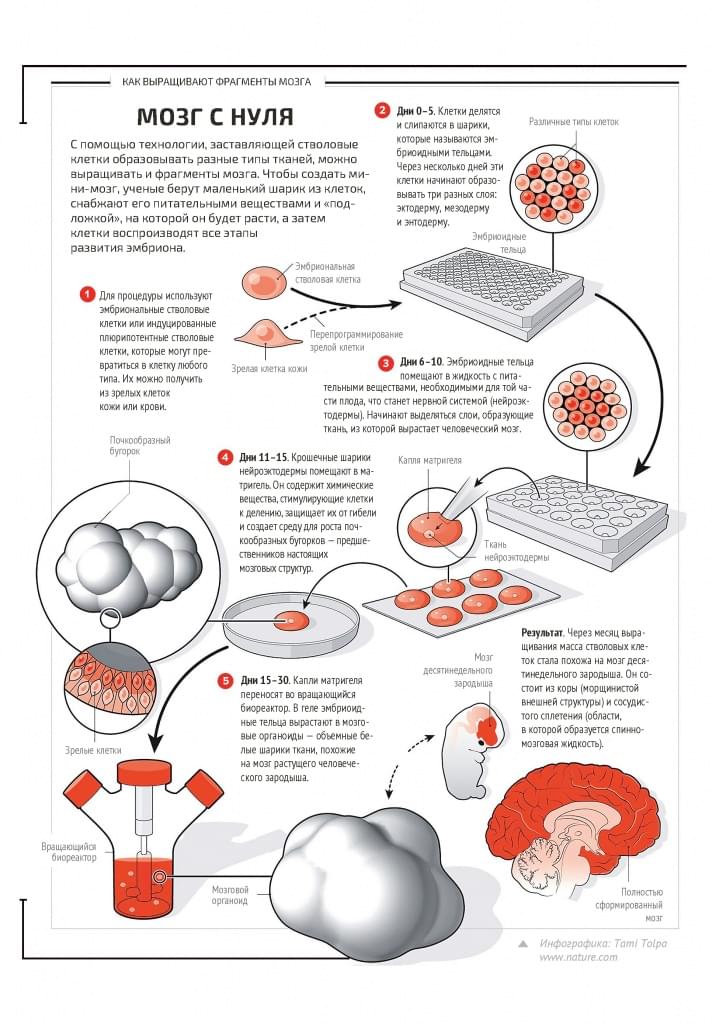
МЫ УЖЕ ДОВОЛЬНО МНОГО ЗНАЕМ об индивидуальном развитии, о том, как формируются органы, какие молекулярные сигналы задействованы в этом процессе, но пока приходится довольствоваться выращенными органами, которые по размеру не превышают органы зародыша. И тут у нас есть и мини-почка, и мини-сердце, способное биться (его в 2015 году описали в Nature Communications исследователи из Калифорнийского университета в Беркли), и мини-легкое с крохотными бронхами, и мини-кишечник с мини-желудком. Есть даже мини-мозг, хотя сотрудники института молекулярной биотехнологии Австрийской академии наук, которые его сделали, предпочитают называть его церебральным органоидом. Его выращивали из индуцированных стволовых клеток (полученных из клеток кожи), которых понуждали развиваться в сторону мозговых нейронов. И клетки сформировали структуру, похожую на мозг девятинедельного зародыша. В нем были зачатки желудочков мозга, элементы будущей коры и мозговых оболочек. Спустя какое-то время мини-мозг останавливался в росте (в нем не было кровеносных сосудов), но продолжал жить. Однако когда другие исследователи из Института Солка (США) сделали такой же органоид и пересадили его в мозг мыши, в него проросли кровеносные сосуды, и он возобновил рост. Более того, новый мозг сумел подсоединиться к «старому» – то есть нейроны мозга-хозяина и органоида нашли контакт друг с другом и начали работать в команде (статья об этом опубликована в Nature Biotechnology в апреле этого года).
 Мини-мозг. Фото: Genome Institute of Singapore, A*STAR, www.nature.com
Мини-мозг. Фото: Genome Institute of Singapore, A*STAR, www.nature.com
НО И НЕПОСРЕДСТВЕННЫЙ практический смысл у мини-органов тоже есть: их можно использовать, например, для тестирования лекарств или токсинов. Обычно такие исследования проводят на клеточных культурах, которые просто растут слоями в лабораторной посуде, или на животных. Даже если отвлечься от этических проблем, все-таки крысы, мыши и кролики во многих отношениях отличаются от человека, да и клеточная культура – это совсем не орган. Мини-почка, мини-кишечник, мини-мозг и прочие мини все же больше похожи на наши настоящие органы, и потому они могут довольно точно рассказать, как отреагирует наше тело на то или иное потенциально полезное или вредное вещество.
Технологии
Кирилл Стасевич













 Психология бренда
Психология бренда  Двойственный союз
Двойственный союз Поправьте мне геном
Поправьте мне геном Неестественная сладость
Неестественная сладость 








